Kjemiske reaksjoner
Fra læreplanen
Energi for framtiden
Mål for opplæringen er at eleven skal kunne
Oppvarming
Hva er:
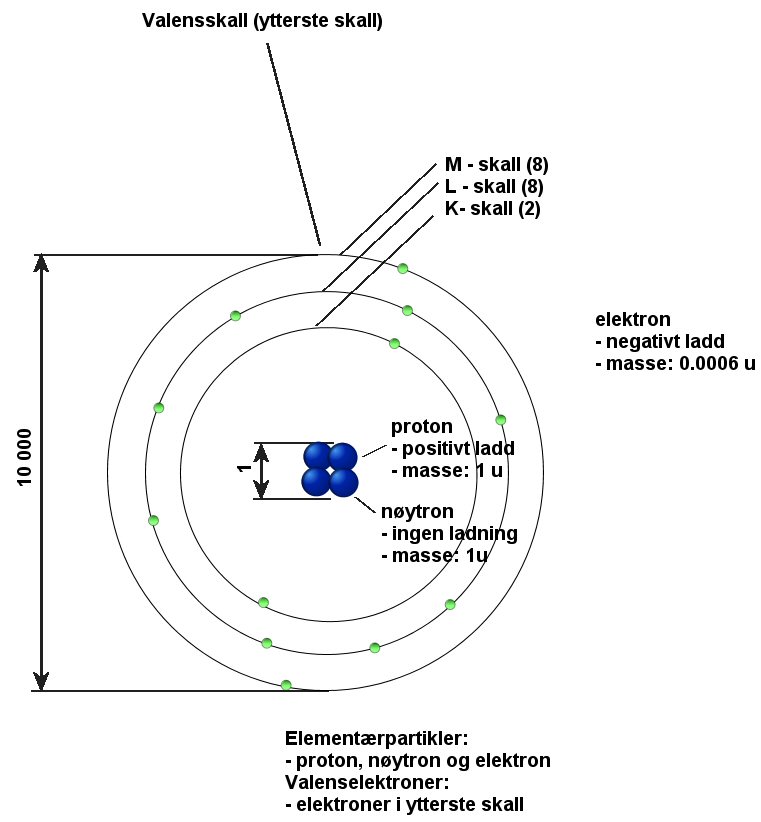
Atomer
Atomet

Hvordan har vi kommet fram til denne modellen?

| 460 - 370 f.Kr | Demokrit |
| 1897 | Thomson oppdager elektronet |
| 1911 | Rutherford: atomet består av stort sett tomrom |
| 1913 | Bohrs atommodell med baner |
| 1932 | Chadwick oppdaget nøytronet |
| 1960 | Kvarker |
Massen til nøytroner og protoner = 1u
1u = 0,000 000 000 000 000 000 000 000 00166 g = 1.66·10-27 g
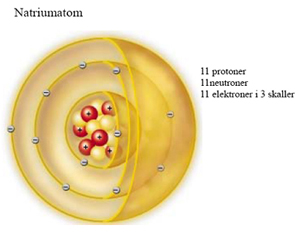
Natrium
Vi ser på et eksempel: Grunnstoff nr. 11 Natrium

Atomkjerner, isotoper og ioner
Hydrogenatomet har som regel en kjerne som bare består av et proton, men det fins andre varianter. Alle har et proton, men antallet nøytroner kan variere fra 0 til 2. Vi kaller disse variantene for isotoper
Vi kan skille mellom de tre typene av hydrogenatomer ved å skrive: 1H , 2H og 3H
Indeksene forteller hvor mange kjernepartikler det er.
Alle atomer som har like mange protoner som elektroner er nøytrale. Hvis antallet er forskjellig, dvs. atomet er ladd, kaller vi det et ion. Det er et gresk ord som betyr vandrer.
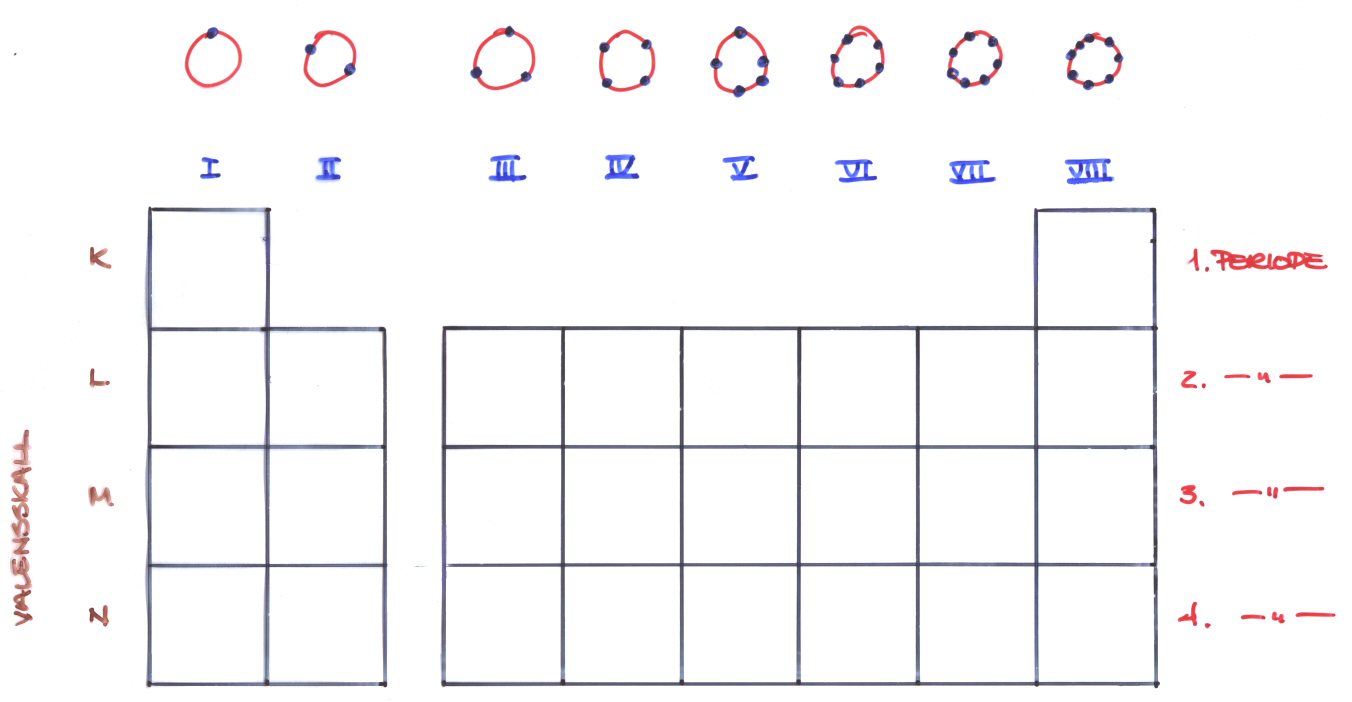
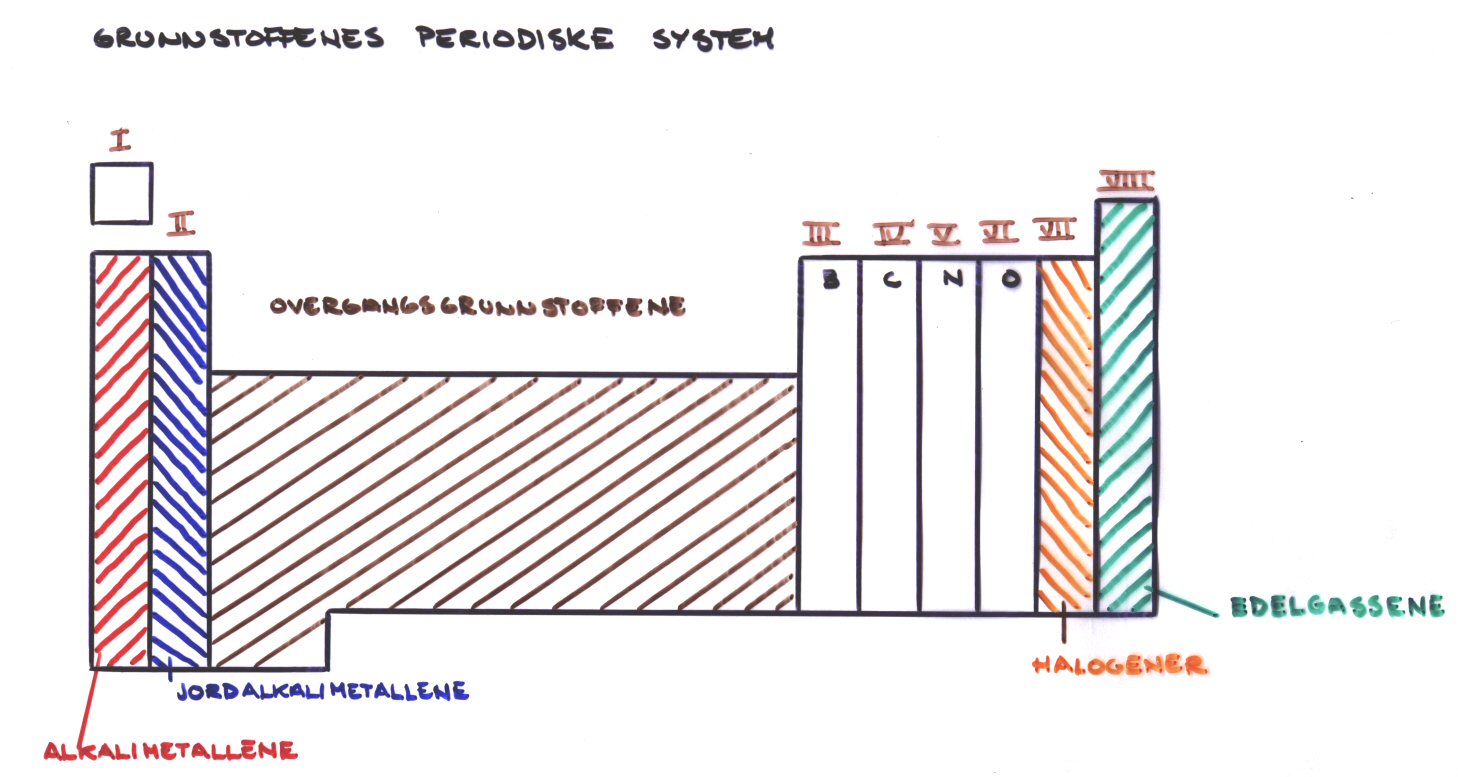
Periodesystemet
Elektronskall og fordeling av elektroner
| Atomnr | Grunnstoff | Symbol | Antall |
Antall elektroner |
Elektroner i skallene | |||
|---|---|---|---|---|---|---|---|---|
| K | L | M | N | |||||
1 |
Hydrogen | H |
1 |
1 |
1 |
- |
||
2 |
Helium | He |
2 |
2 |
2 |
- |
||
3 |
Litium | Li |
3 |
3 |
2 |
1 |
||
4 |
Beryllium | Be |
4 |
4 |
2 |
2 |
||
5 |
Bor | B |
5 |
5 |
2 |
3 |
||
6 |
Karbon | C |
6 |
6 |
2 |
4 |
||
7 |
Nitrogen | N |
7 |
7 |
2 |
5 |
||
8 |
Oksygen | O |
8 |
8 |
2 |
6 |
||
9 |
Fluor | F |
9 |
9 |
2 |
7 |
||
10 |
Neon | Ne |
10 |
10 |
2 |
8 |
||
11 |
Natrium | Na |
11 |
11 |
2 |
8 |
1 |
|
12 |
Magnesium | Mg |
12 |
12 |
2 |
8 |
2 |
|
13 |
Aluminium | Al |
13 |
13 |
2 |
8 |
3 |
|
14 |
Silisium | Si |
14 |
14 |
2 |
8 |
4 |
|
15 |
Fosfor | P |
15 |
15 |
2 |
8 |
5 |
|
16 |
Svovel | S |
16 |
16 |
2 |
8 |
6 |
|
17 |
Klor | Cl |
17 |
17 |
2 |
8 |
7 |
|
18 |
Argon | Ar |
18 |
18 |
2 |
8 |
8 |
|
19 |
Kalium | K |
19 |
19 |
2 |
8 |
8 |
1 |
20 |
Kalsium | Ca |
20 |
20 |
2 |
8 |
8 |
2 |
Grupper og perioder
Kjemiske bindinger
Typer
Elektronparbinding (kovalent binding)
Vi har sett at hydrogenatomet har ett eletron i ytterste skall. For å få fylt opp ytterste skall mangler det ett elektron. Støter et hydrogenatom sammen med et annet kan det dannes et hydrogenmolekyl ved at de to hydrogenatomene deler på de to elektronene. Denne typen binding kalles elektronparbinding eller kovalent binding. Dette illustrerer vi slik:
H· + · H→ H : H
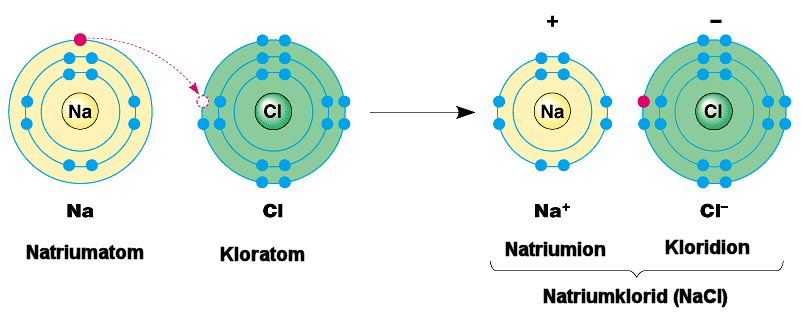
Ionebinding
I noen tilfeller
Lenker
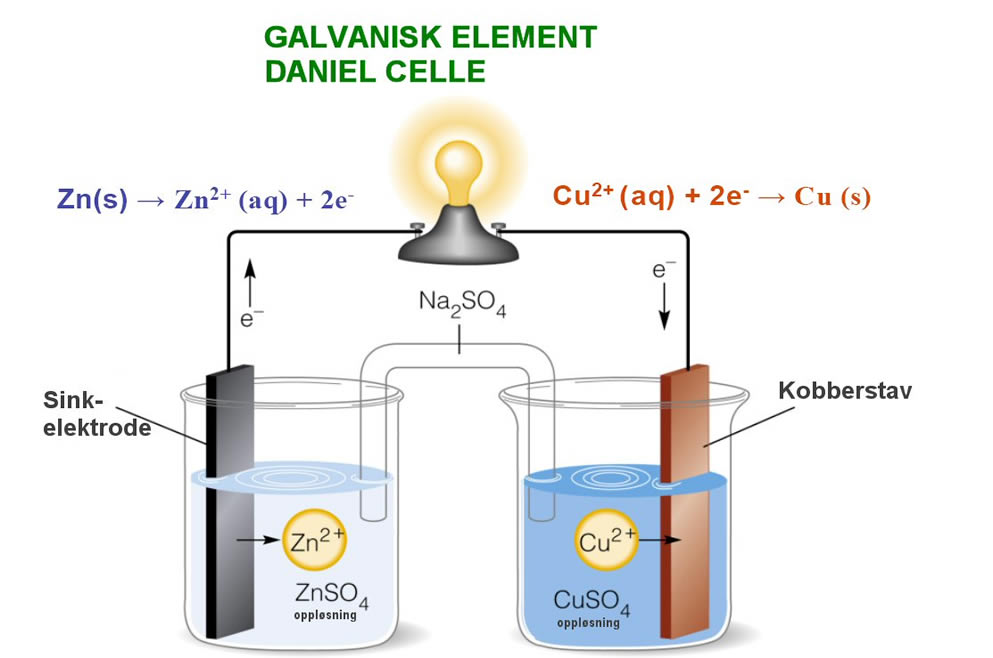
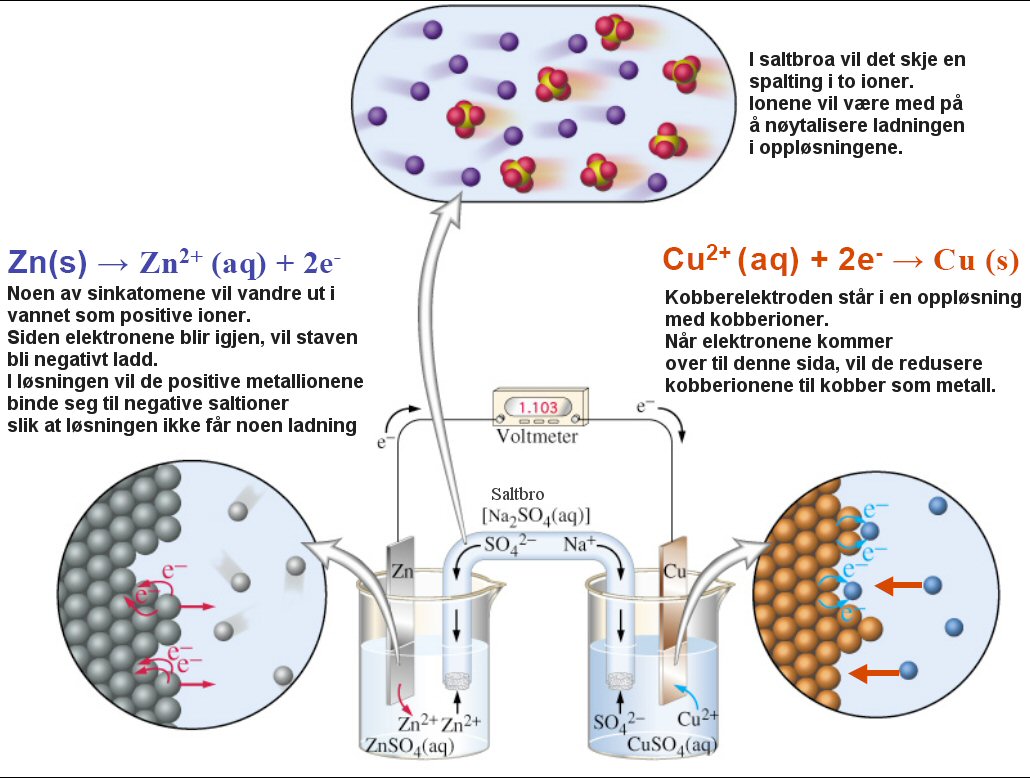
Redoks-reaksjoner
I reaksjonslikninga over, hvor NaCl dannes, skjer det en redoksreaksjon:Reduksjon: tilføring av elektroner
Oksidasjon: fjerning av elektroner
Oksidasjonsmiddel: Et stoff som forårsaker at et annet stoff blir oksidert
Reduksjonsmiddel: Et stoff som forårsaker at et annet stoff blir redusert
Spenningsrekka
Her er en korrekt versjon av spenningsrekka: http://kosmossf.cappelendamm.no/c35909/binfil/download.php?tid=543856
Mer om spenningsrekka finner du på NDLA: NDLA: Spenningsrekka
På hjemmesida til boka er det ei korrigert spenningsrekke. Se her
Elektrolyse
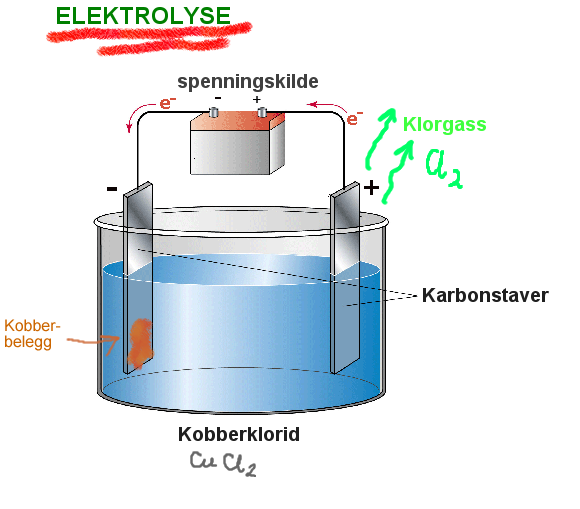
Katode: Cu2++2e-→ Cu
Anode: 2Cl- → Cl2 + 2e-