Energikilder
Læreplanen
Energi for framtiden
Mål for opplæringen er at eleven skal kunne
Batterier
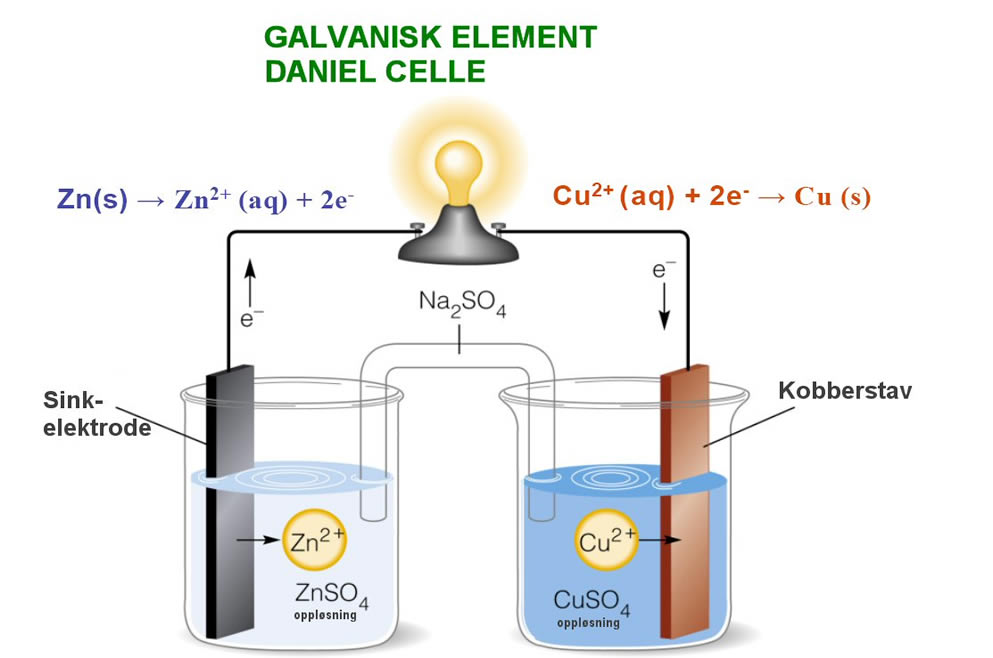
Galvanisk element

Batterityper
Et eksempel
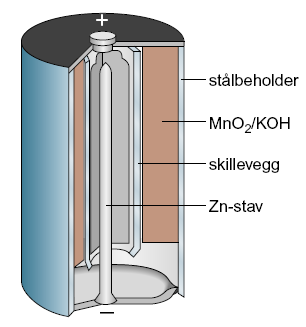 |
Alkalisk element
|
En oversikt
| Type | + pol | - pol | elektrolytt | Ems | |
| ikke-ladbare | Tørrelement | MnO2 | Zn | NH4Cl | 1.5 V |
| Alkalisk | MnO2 | Zn | KOH | 1.5 V | |
| Litium | MnO2 | Li | KOH | 3.4 V | |
| Knappecelle | Ag2O | Zn | KOH | 1.6 V | |
| ladbare | Blyakkumulator | PbO2 | Pb | H2SO4 | 2.0 V |
| Nikkel-kadmium | Ni(OH)2 | Cd | KOH | 1.2 V | |
| Nikkelmetallhybrid | Ni(OH)2 | MH | KOH | 1.2 V | |
| Litiumion | Li2O | C | LiBF4 | 3.4 V |
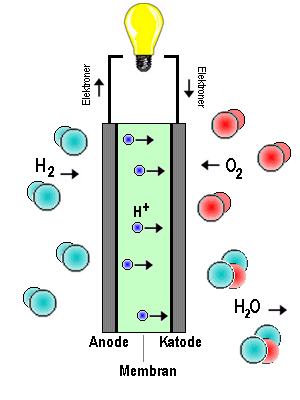
Brenselceller
 |
|